புதிய வெளியீடுகள்
புதிய மரபணு வழிமுறைகள் க்ளியோமாவுக்கு எதிரான சிகிச்சை இலக்கை வழங்கக்கூடும்
கடைசியாக மதிப்பாய்வு செய்யப்பட்டது: 02.07.2025

அனைத்து iLive உள்ளடக்கம் மருத்துவ ரீதியாக மதிப்பாய்வு செய்யப்படும் அல்லது முடிந்தவரை உண்மையான துல்லியத்தை உறுதி செய்ய உண்மையில் சரிபார்க்கப்படுகிறது.
நாம் கடுமையான ஆதார வழிகாட்டுதல்களை கொண்டிருக்கிறோம் மற்றும் மரியாதைக்குரிய ஊடக தளங்கள், கல்வி ஆராய்ச்சி நிறுவனங்கள் மற்றும் சாத்தியமான போதெல்லாம், மருத்துவ ரீதியாக மதிப்பாய்வு செய்யப்பட்ட படிப்புகளை மட்டுமே இணைக்கிறோம். அடைப்புக்களில் உள்ள எண்கள் ([1], [2], முதலியன) இந்த ஆய்வுகள் தொடர்பான கிளிக் செய்யக்கூடியவை என்பதை நினைவில் கொள்க.
எங்கள் உள்ளடக்கத்தில் எதையாவது தவறாக, காலதாமதமாக அல்லது சந்தேகத்திற்குரியதாகக் கருதினால், தயவுசெய்து அதைத் தேர்ந்தெடுத்து Ctrl + Enter ஐ அழுத்தவும்.
நரம்பியல் துறையின் நியூரோ-ஆன்காலஜியின் கென் மற்றும் ரூத் டேவி பிரிவின் பேராசிரியரான ஷி-யுவான் செங்கின் ஆய்வகத்தில் இருந்து மேற்கொள்ளப்பட்ட ஒரு ஆய்வு, க்ளியோமா கட்டி செல்களில் மாற்று ஆர்.என்.ஏ பிளவுபடுத்தும் நிகழ்வுகளுக்கு அடிப்படையான புதிய வழிமுறைகளை அடையாளம் கண்டுள்ளது, அவை புதிய சிகிச்சை இலக்குகளாக செயல்படக்கூடும். இந்த ஆய்வு முடிவுகள் ஜர்னல் ஆஃப் கிளினிக்கல் இன்வெஸ்டிகேஷன் இதழில் வெளியிடப்பட்டுள்ளன.
" மாற்று பிளவுபடுத்தலின் லென்ஸ் மூலம் க்ளியோமாவுக்கு சிகிச்சையளிப்பதற்கான ஒரு வித்தியாசமான வழியை நாங்கள் கண்டுபிடித்துள்ளோம், மேலும் முன்னர் அடையாளம் காணப்படாத ஆனால் க்ளியோமா வீரியத்திற்கு முக்கியமான புதிய இலக்குகளைக் கண்டுபிடித்துள்ளோம்" என்று நரம்பியல் இணைப் பேராசிரியரும் ஆய்வின் முதன்மை ஆசிரியருமான எம்.டி., பி.எச்.டி., சியாவோ சாங் கூறினார்.
க்ளியோமாக்கள் பெரியவர்களில் முதன்மை மூளைக் கட்டியின் மிகவும் பொதுவான வகையாகும், மேலும் அவை மத்திய நரம்பு மண்டலத்தில் வசிக்கும் மற்றும் அண்டை நியூரான்களை ஆதரிக்கும் கிளைல் செல்களிலிருந்து உருவாகின்றன. கட்டியின் மரபணு மற்றும் எபிஜெனெடிக் பன்முகத்தன்மை காரணமாக, கதிர்வீச்சு மற்றும் கீமோதெரபி உள்ளிட்ட நிலையான சிகிச்சைகளுக்கு க்ளியோமாக்கள் மிகவும் எதிர்ப்புத் தெரிவிக்கின்றன, இது புதிய சிகிச்சை இலக்குகளைக் கண்டறிய வேண்டியதன் அவசியத்தை எடுத்துக்காட்டுகிறது.
புற்றுநோய் ஆராய்ச்சி இதழில் வெளியிடப்பட்ட செங் ஆய்வகத்தின் முந்தைய ஆராய்ச்சி, சாதாரண மூளைகளுடன் ஒப்பிடும்போது க்ளியோமாஸில் முக்கியமான பிளவுபடுத்தும் காரணி SRSF3 கணிசமாக உயர்ந்துள்ளது என்பதைக் காட்டுகிறது, மேலும் SRSF3-ஒழுங்குபடுத்தப்பட்ட RNA பிளவுபடுத்தல் கட்டி செல்களில் பல செல்லுலார் செயல்முறைகளை பாதிப்பதன் மூலம் க்ளியோமா வளர்ச்சி மற்றும் முன்னேற்றத்தை ஊக்குவிக்கிறது.
ஆர்.என்.ஏ பிளவுபடுத்தல் என்பது இன்ட்ரான்களை (ஆர்.என்.ஏவின் குறியீட்டு அல்லாத பகுதிகள்) அகற்றுதல் மற்றும் எக்ஸான்களை (குறியீட்டு பகுதிகள்) இணைப்பதன் மூலம் ஒரு கலத்தில் மரபணு வெளிப்பாட்டை ஆதரிக்கும் ஒரு முதிர்ந்த எம்.ஆர்.என்.ஏ மூலக்கூறை உருவாக்குவதை உள்ளடக்கிய ஒரு செயல்முறையாகும்.
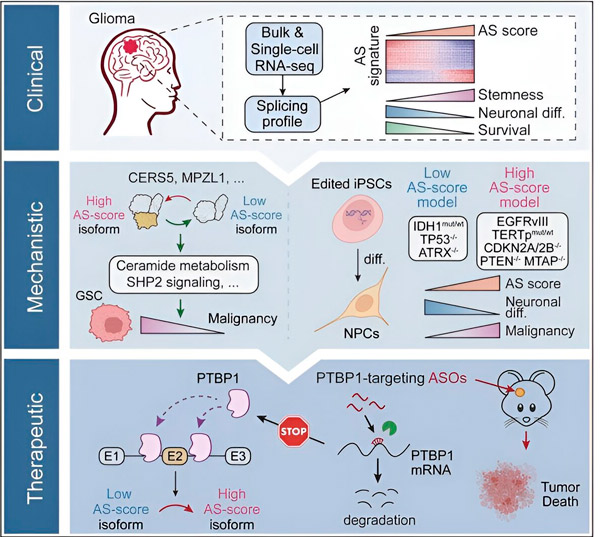
தற்போதைய ஆய்வில், விஞ்ஞானிகள் க்ளியோமா கட்டி செல்களில் மாற்று பிளவுபடுத்தலில் ஏற்படும் மாற்றங்களை அடையாளம் காண்பதையும், இந்த மாற்றங்களுக்கு அடிப்படையான வழிமுறைகளையும், சிகிச்சை இலக்குகளாக அவற்றின் திறனைத் தீர்மானிப்பதையும் நோக்கமாகக் கொண்டுள்ளனர்.
கணக்கீட்டு முறைகள் மற்றும் RNA வரிசைமுறை தொழில்நுட்பங்களைப் பயன்படுத்தி, நோயாளி மாதிரிகளிலிருந்து க்ளியோமா கட்டி செல்களில் ஏற்படும் பிளவு மாற்றங்களை ஆராய்ச்சியாளர்கள் ஆய்வு செய்தனர். இந்த மாற்றங்களை உறுதிப்படுத்த, மனிதனால் தூண்டப்பட்ட ப்ளூரிபோடென்ட் ஸ்டெம் செல்களிலிருந்து (iPSCs) பெறப்பட்ட க்ளியோமா மாதிரிகளில் வெவ்வேறு க்ளியோமா இயக்கி பிறழ்வுகளை அறிமுகப்படுத்த CRISPR மரபணு எடிட்டிங் தொழில்நுட்பங்களைப் பயன்படுத்தினர்.
இந்த பிளவு மாற்றங்கள் எபிடெர்மல் வளர்ச்சி காரணி ஏற்பி III (EGFRIII) இன் மாறுபாட்டால் மேம்படுத்தப்படுகின்றன என்பதை அவர்கள் கண்டறிந்தனர், இது க்ளியோமாஸ் உட்பட பல கட்டிகளில் அதிகமாக வெளிப்படுத்தப்படுவதாக அறியப்படுகிறது, மேலும் IDH1 மரபணுவில் உள்ள ஒரு பிறழ்வால் தடுக்கப்படுகிறது.
வெவ்வேறு அமினோ அமில வரிசைகளுடன் வெவ்வேறு புரத ஐசோஃபார்ம்களை உருவாக்கும் இரண்டு ஆர்.என்.ஏ பிளவு நிகழ்வுகளின் செயல்பாட்டை ஆராய்ச்சியாளர்கள் உறுதிப்படுத்தியுள்ளனர்.
"சாதாரண மூளையில் பொதுவாக வெளிப்படுத்தப்படும் மற்ற ஐசோஃபார்முக்கு மாறாக, இந்த ஐசோஃபார்ம்களில் ஒன்று மட்டுமே கட்டி வளர்ச்சியை ஊக்குவிக்க முடியும். கட்டிகள் சாதாரண மூளை ஐசோஃபார்மை விட கட்டியை ஊக்குவிக்கும் ஐசோஃபார்மைத் தேர்ந்தெடுத்து வெளிப்படுத்த இந்த பொறிமுறையைப் பயன்படுத்துகின்றன," என்று சாங் கூறினார்.
பின்னர் அந்தக் குழு அப்ஸ்ட்ரீம் ஆர்.என்.ஏ-பிணைப்பு புரதங்களை பகுப்பாய்வு செய்து, க்ளியோமா செல்களில் கட்டியை ஊக்குவிக்கும் ஆர்.என்.ஏ பிளவுபடுதலை PTBP1 மரபணு ஒழுங்குபடுத்துகிறது என்பதைக் கண்டறிந்தது. நோயெதிர்ப்பு குறைபாடுள்ள எலிகளில் ஆர்த்தோடோபிக் க்ளியோமா மாதிரியைப் பயன்படுத்தி, ஆராய்ச்சியாளர்கள் ஆன்டிசென்ஸ் ஒலிகோநியூக்ளியோடைடு (ASO) அடிப்படையிலான சிகிச்சையுடன் PTBP1 ஐ இலக்காகக் கொண்டனர், இது இறுதியில் கட்டி வளர்ச்சியை அடக்கியது.
"எங்கள் தரவு, க்ளியோமா வீரியம் மற்றும் பன்முகத்தன்மையை பாதிப்பதில் மாற்று ஆர்.என்.ஏ பிளவுபடுத்தலின் பங்கையும், வயதுவந்த க்ளியோமாக்களின் சிகிச்சைக்கான சிகிச்சை பாதிப்பாக அதன் ஆற்றலையும் எடுத்துக்காட்டுகிறது" என்று ஆய்வு ஆசிரியர்கள் எழுதினர்.
ஆராய்ச்சியாளர்களுக்கான அடுத்த படி, கட்டி எதிர்ப்பு நோயெதிர்ப்பு மறுமொழியை வெளிப்படுத்த PTBP1 ஐ குறிவைப்பதன் திறனை ஆராய்வதாகும் என்று சாங் கூறினார்.
"நீண்ட காலமாகப் படிக்கப்பட்ட RNA வரிசைமுறை பகுப்பாய்வைப் பயன்படுத்தி, க்ளியோமா செல்களில் PTBP1 ஐ இலக்காகக் கொண்டதன் மூலம், சாதாரண திசுக்களில் இல்லாத பல மாற்றுப் பிளவுபட்ட டிரான்ஸ்கிரிப்டுகள் உருவாகின்றன என்பதைக் கண்டறிந்தோம். எனவே, நோயெதிர்ப்பு அமைப்பு கட்டியை சிறப்பாக அடையாளம் காணும் வகையில், இந்த ஐசோஃபார்ம் சில ஆன்டிஜென்களை உருவாக்க முடியுமா என்பதைக் கண்டுபிடிப்பதே எங்கள் அடுத்த திட்டம்," என்று சாங் கூறினார்.
நோயெதிர்ப்பு செல்கள் போன்ற க்ளியோமா நோயாளிகளிடமிருந்து கட்டி அல்லாத செல்களில் ஏற்படும் பிளவு மாற்றங்களை பகுப்பாய்வு செய்வதில் தங்கள் குழு ஆர்வமாக இருப்பதாகவும் சாங் மேலும் கூறினார்.
"செல்லின் செயல்பாட்டை ஒழுங்குபடுத்துவதற்கு பிளவுபடுத்தல் மிகவும் முக்கியமானது என்பதை நாங்கள் ஏற்கனவே அறிவோம், எனவே இது கட்டி வீரியத்தை ஒழுங்குபடுத்துவது மட்டுமல்லாமல், புற்றுநோயை திறம்பட கொல்ல முடியுமா என்பதை தீர்மானிக்க நோயெதிர்ப்பு செல்களின் செயல்பாட்டையும் ஒழுங்குபடுத்த முடியும். எனவே, கட்டியில் ஊடுருவிய நோயெதிர்ப்பு செல்களில், ஒரு நோயெதிர்ப்பு செல் கட்டிக்குள் ஊடுருவிய பிறகு பிளவுபடுவதில் மாற்றம் உள்ளதா என்பதைப் பார்க்க, சில உயிர் தகவலியல் பகுப்பாய்வுகளையும் நாங்கள் செய்து வருகிறோம்."
"நோயெதிர்ப்பு-அடக்கும் கட்டி நுண்ணிய சூழலை வடிவமைப்பதில் மாற்று பிளவுபடுத்தலின் பங்கைத் தீர்மானிப்பதும், க்ளியோமாவில் நோயெதிர்ப்பு சிகிச்சையின் செயல்திறனை மேம்படுத்துவதற்கான சாத்தியமான இலக்குகளை அடையாளம் காண்பதும் எங்கள் குறிக்கோள்" என்று சாங் கூறினார்.
